High-speed atomic force microscopy reveals rotary catalysis of rotorless F1-ATPase
要旨
ATPは生物のエネルギー供給源となる物資であり「エネルギー通貨」とも称される。
このATPを合成するATP合成酵素は、物理的な回転を利用して、ATPを化学合成するユニークな酵素である。
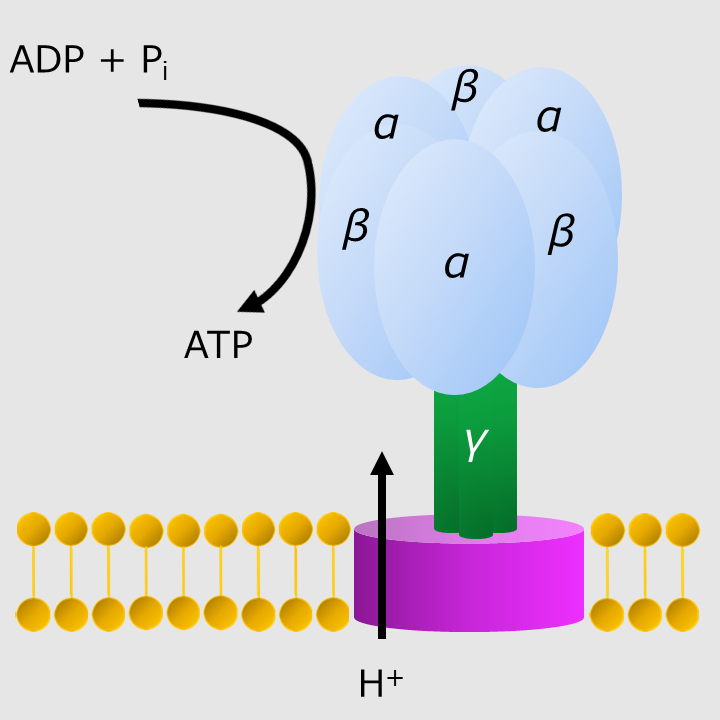
F1-ATPaseはATP合成酵素の一部であり、単離したF1-ATPaseはATPを分解しながら回転する。F1-ATPaseの回転では、回転子の周りの3つのαβが順々に構造変化を起こし、回転子(γ)が回転する。
従来、この協同的な構造変化を律しているのが、回転子ではないかと考えられていた。
しかし、本研究で、回転子のないF1-ATPase を高速AFMで観察したところ、協同的な構造変化が観察された。これは、従来のモデルを覆す結果であった。
Keyword: ATP合成酵素の構造と機能
F1-ATPaseの回転モーターは、3組のαβと1つのγから構成され、γを軸にした回転モーターのような構造をもつ。
3組のαβにそれぞれ1つのATPが結合し、3つのATPを分解して、酵素は1回転する。
一方で、外力を加えて酵素を1回転させると3つのATPを合成できる。
観察結果
この研究では、回転子γのないF1-ATPaseを高速AFMで観察している。
ATPが存在しているとき、3組のαβのそれぞれのβサブユニットのうちの2つがATPの結合していない「開いた」構造(以下O)からATPが結合した「閉じた」構造(以下C)に変化することが示された。
さらに、この構造変化は一過性のものではなく、OCC→COC→CCO→OCC→・・・・・と周期的に進行することが明らかになった。
この周期的な構造変化は、γを持つ完全なF1-ATPaseの回転と同じ反時計回りに進行し、その速度は系に存在するATP濃度によって律速される。
これらの結果は、3組のαβの協同的な構造変化は、γによって制御されているのではないことを示しており、従来の仮説を覆す結果となった。
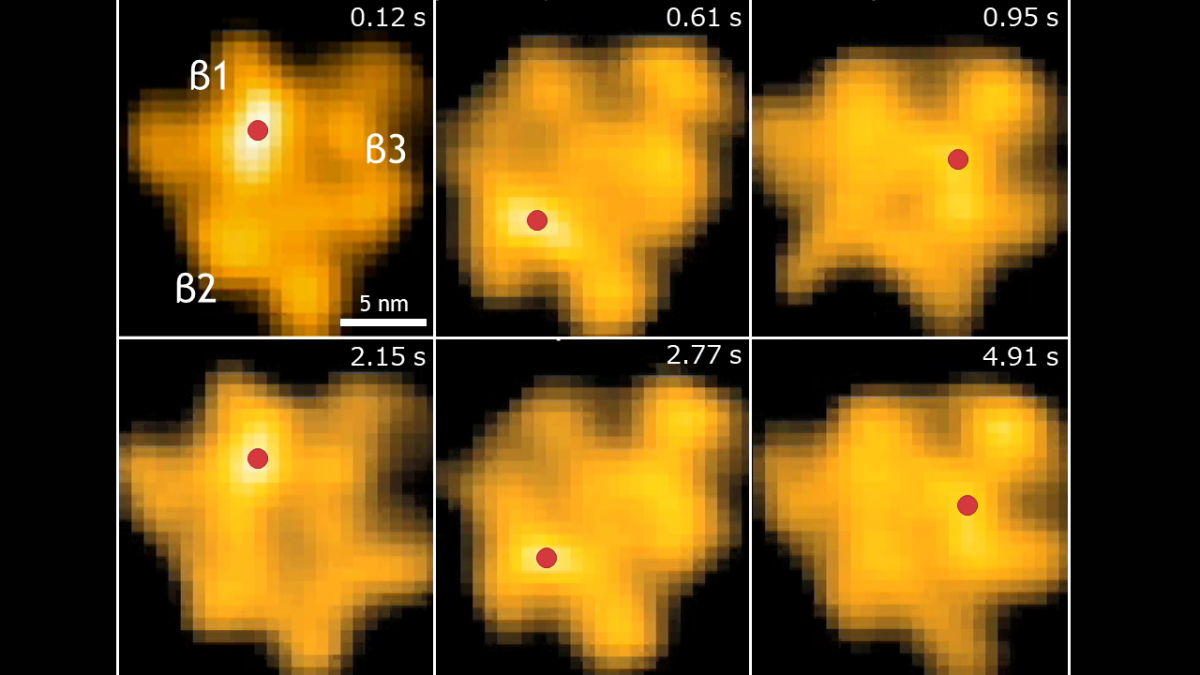
高速AFM観察画像

HS-AFMで取得したα3β3サブユニット(回転子γのないF1-ATPase)の周期的な構造変化像。
2 µMのATP存在下で解析を行った。
赤い点βサブユニットがATPの結合していない「開いた」構造である事を示す。
時間経過とともに赤い点がβ1→β2→β3と反時計回りに移動しており、γがないF1-ATPaseも周期的な構造変化を起こすことが示されている。(名古屋大学大学院 内橋教授 ご提供)
関連するWebコンテンツのご紹介
下記リンクから動画等をご覧いただけます。
出典論文
Uchihashi T, Iino R, Ando T, Noji H.
High-speed atomic force microscopy reveals rotary catalysis of rotorless F₁-ATPase
Science 2011;333(6043):755-758. doi:10.1126/science.1205510
https://science.sciencemag.org/content/333/6043/755.full